1. Periode
2. Golongan
3. Blok-s
4. Blok-p
5. Blok-d
6. Blok-f
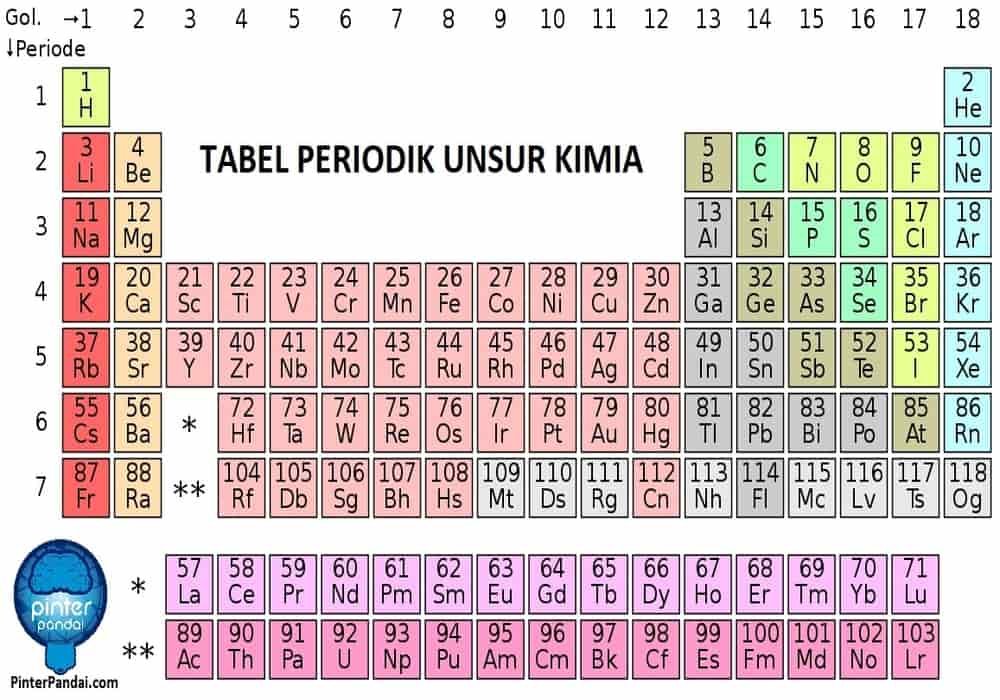
1. Membaca Tabel Periodik Kimia Mulai Dari Kiri Atas Ke Kanan Bawah
2. Pahami Unsur Kimia
perlu memahami terlebih dahulu bahwa setiap unsur mengandung 1 proton lebih banyak daripada atom disebelah kirinya di tabel periodik. Cara mengetahuinya bisa melihat nomor atom yang tersusun dari kiri ke kanan.
Unsur-unsur ini kemudian juga dipisahkan menjadi 3 golongan yang tampak pada tabel periodik. Misalnya baris pertama menunjukan hidrogen yang memiliki nomor atom 1, dan helium memiliki nomor atom 2, maka kedua unsur tersebut terletak diujung tabel periodik sebelah kiri dan kanan karena berada pada golongan yang berbeda.
3. Kenali Golongan Atom Yang Memiliki Sifat Fisik Yang Sama
Golongan pada tabel periodik kemudian ditampilkan oleh kolom vertikal. Pada beberapa kasus, golongan dicirikan dengan beberapa warna yang sama. Warna-warna ini akan membantu mengidentifikasi unsur-unsur mana yang memiliki sifat fisik dan kimia yang hampir mirip.
Jadi Grameds akan lebih mudah memprediksi reaksi unsur kimia tersebut dari setiap golongan tertentu dengan jumlah elektron yang sama.
Hampir semua unsur kimia hanya masuk dalam satu golongan, kecuali hidrogen yang bisa masuk kelompok halogen atau logam alkali. Pada tabel periodik kimia, hidrogen bahkan muncul di kedua golongan, Grameds harus mengetahui hal ini.
4. Perhatian Ruang Kosong Pada Tabel
juga perlu memperhatikan penyusunan unsur-unsur ke dalam kelompok dan golongan karena dapat mempertimbangkan sifat-sifat fisik dan kimia yang sama. Carai ini akan lebih memudahkan untuk memahami cara setiap unsur tersebut bereaksi. Jika unsur kimia bertambah maka penggolongannya juga akan semakin sulit, itulah sebabnya ada ruang kosong pada tabel periodik kimia.
Contohnya pada 3 baris pertama memiliki ruang kosong karena berfungsi untuk logam transisi yang akan dimunculkan di tabel periodik, yakni nomor atom 21. Sama halnya dengan unsur 57 sampai 71 yang juga merupakan unsur bumi yang langka atau unsur tanah yang ditampilkan terpisah di bagian kanan bawah tabel periodik.
5. Perhatian Bahwa Setiap Baris Disebut Periode
Setiap unsur pada satu periode pasti memiliki jumlah orbital atom yang sama, yang selanjutnya akan dilintasi oleh elektron-elektron. Jumlah orbital kemudian akan sesuai dengan jumlah periode pada tabel periodik yang menunjukan 7 baris yang berarti juga 7 periode.
Contohnya unsur periode 1 memiliki 1 orbital, sedangkan unsur periode 7 juga memiliki 7 orbital. Pada beberapa kasus contoh tersebut diberi nomor 1-7 dari atas ke bawah pada bagian kiri tabel periodik.
5. Bedakan Antara Logam, Semilogam, dan Nonlogam
Jika mengenal jenis unsurnya, maka Grameds akan lebih mudah memahami sifat-sifat unsur pada tabel periodik. Inilah guna warna pada tabel periodik yang menunjukan apakah unsur tersebut masuk kelompok logam, semi logam, atau nonlogam.
Perhatikan pembedanya, Grameds bisa menemukan unsur logam di kanan tabel, sedangkan non logam di bagian kiri. Sedangkan kelompok semi logam berada di antara logam dan nonlogam.

Comments
Post a Comment